- Auteur Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:46.
- Laatst gewijzigd 2025-06-01 07:37.
Het belangrijkste verschil tussen alfa- en bèta-helix hangt af van het type waterstofbinding dat ze vormen bij het ontwikkelen van deze structuren. Alfa-helices vormen intramoleculaire waterstofbruggen, terwijl de bèta-helices intermoleculaire waterstofbruggen vormen.
Complexe eiwitten hebben vier structurele organisatieniveaus: primair, secundair, tertiair en quaternair. De secundaire structuren van eiwitten vormen de peptideketens in verschillende oriëntaties. De peptideketens bestaan uit aminozuursequenties gebonden door peptidebindingen. Daarom zijn er twee belangrijke secundaire structuren in eiwitten als alfa-helix en bèta-helix. Daarnaast zijn er nog andere secundaire structuren die de bèta-bocht- en haarspeldstructuren worden genoemd. Dit artikel richt zich voornamelijk op het verschil tussen alfa- en bèta-helix.
Wat is Alpha Helix?
Eiwitten hebben vier structurele organisatieniveaus. Hiervan is de alfa-helix de meest voorkomende secundaire structuur van eiwitten. En deze structuur verschijnt als een staaf die rond een centrale as is gewikkeld. Verder is de alfa-helix een rechtshandige helix. Er kunnen echter ook linkshandige helices aanwezig zijn. Hier vormen de peptidebindingen van het amino-uiteinde naar het carboxy-uiteinde. Aminozuren verbinden zich met elkaar via deze peptidebindingen. Intramoleculaire waterstofbruggen zijn de belangrijkste oorzaak voor de vorming van de alfa-helix.
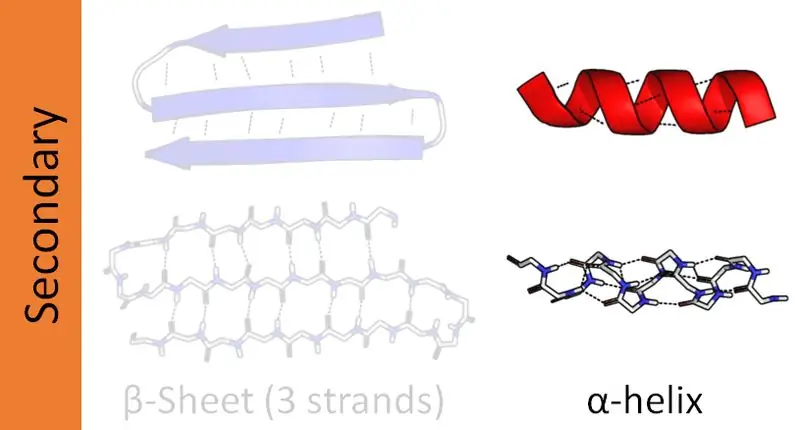
Figuur 01: Alpha Helix
De rangschikking van de alfa-helix hangt af van de hydrofiele en hydrofobe aard van het eiwit. Als de aminozuursequentie uit een groot aantal hydrofiele R (variabele) groepen bestaat, oriënteren de R-groepen zich naar de waterige fase. Als de variabele groepen hydrofoob zijn, zullen ze uitsteken naar de hydrofobe fase van de omgeving. In beide scenario's lijken de R-groepen zich buiten de spiraalvormige structuur uit te strekken. Vanwege deze structurele kenmerken is alfa-helix beter bestand tegen mutaties. Zo stabiliseert de aanwezigheid van waterstofbruggen de structuur van de alfa-helix. Er zijn gemiddeld 3,6 residu's per beurt in een alfa-helix, omdat er 3,6 residu's nodig zijn om de waterstofbruggen te ontwikkelen. Sommige structurele eiwitten zoals collageen en keratine zijn rijk aan alfa-helices.
Wat is Beta Helix?
Een bèta-helix is de op één na meest voorkomende secundaire structuur van een eiwit. Hoewel het niet zo gebruikelijk is als de alfa-helix, speelt de aanwezigheid van bèta-helices ook een belangrijke rol in de eiwitstructuur. De vorming van de bèta-helix vindt plaats via twee bètabladen die parallel of antiparallel zijn gerangschikt. Deze vellen vormen vervolgens een spiraalvormige structuur. Intermoleculaire waterstofbruggen tussen twee velstrengen helpen bij de vorming van een bèta-helix.

Figuur 02: Beta Helix
Beta-helices kunnen zowel rechtshandig als linkshandig zijn, afhankelijk van hun bindingspatronen. Bij het vormen van een bèta-helix zullen de variabele groepen van de twee bèta-bladen zich in de kern van de helix rangschikken. Daarom heeft de meerderheid van de groepen die bètabladen vormen hydrofobe functies.
In tegenstelling tot de alfa-helix vormen 17 residuen één draai in bèta-helices. Metaalionen hebben het vermogen om de vorming van Beta-helix te activeren. Net als bij de alfa-helix ondersteunen de waterstofbruggen om de structuur van de bèta-helix te behouden. Koolzuuranhydrase-enzym en pectaatlyase zijn twee eiwitten die rijk zijn aan bèta-helices.
Wat zijn de overeenkomsten tussen Alpha en Beta Helix?
- Alpha en Beta Helix zijn twee secundaire structuren van eiwitten.
- Aminozuren zijn de monomeren van beide secundaire structuren.
- Bovendien zijn de chemische bestanddelen van de alfa- en bèta-helices koolstof, waterstof, zuurstof, stikstof en zwavel.
- Ook ontwikkelen beide secundaire structuren zich tot een organisatie op een hoger niveau.
- Bovendien worden beide gestabiliseerd door waterstofbruggen.
- In beide structuren wordt de hydrofobiciteit bepaald door de aanwezigheid van de R-groepen van de aminozuren.
Wat is het verschil tussen Alpha en Beta Helix?
Het belangrijkste verschil tussen de alfa- en bèta-helix is het type waterstofbinding dat ze laten zien. Alfa-helix vertoont intramoleculaire waterstofbinding, terwijl beta-helix intermoleculaire waterstofbinding vertoont. Bovendien vormt de alfa-helix een rechtshandige helix, terwijl de bèta-helix zowel rechts- als linkshandige helices kan vormen. Dit is dus ook een significant verschil tussen alfa- en bèta-helix.
Bovendien is een ander verschil tussen alfa- en bèta-helix dat de alfa-helix-vorming plaatsvindt door het verdraaien van de aminozuursequentie, terwijl bij bèta-helix-vorming de twee bèta-vellen, parallel of anti-parallel, gebonden zijn aan vormen de spiraalvormige structuur.
De onderstaande infografiek geeft meer informatie over het verschil tussen alfa- en bèta-helix.

Samenvatting - Alpha vs Beta Helix
Zowel alfa-helices als bèta-helices zijn belangrijk bij het identificeren en afleiden van complexe eiwitstructuren. Beide typen zijn secundaire structuren van eiwitten. Alfa-helix is echter een spiraalvormige draai van aminozuursequenties. Daarentegen vindt de vorming van bèta-helix plaats via de waterstofbinding van parallelle of anti-parallelle bèta-platen. Verder is de waterstofbinding intramoleculair in alfa-helixvorm, terwijl de waterstofbinding intermoleculair is in bèta-helixvorm. Bovendien hebben beide structuren een R-groep, die de hydrofobiciteit van het eiwit bepa alt. Dit vat dus het verschil samen tussen alfa- en bèta-helix.






