- Auteur Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:46.
- Laatst gewijzigd 2025-06-01 07:37.
Belangrijk verschil - Sterke ligand versus zwakke ligand
Een ligand is een atoom, ion of molecuul dat twee van zijn elektronen doneert of deelt via een covalente coördinaatbinding met een centraal atoom of ion. Het concept van liganden wordt besproken onder coördinatiechemie. Liganden zijn chemische soorten die betrokken zijn bij de vorming van complexen met metaalionen. Daarom worden ze ook wel complexvormers genoemd. Liganden kunnen eentandig, tweetandig, drietandig, enz. zijn op basis van de denticiteit van het ligand. Denticiteit is het aantal donorgroepen dat aanwezig is in een ligand. Monodentaat betekent dat ligand slechts één donorgroep heeft. Bidentaat betekent dat het twee donorgroepen per ligandmolecuul heeft. Er zijn twee hoofdtypen liganden gecategoriseerd op basis van kristalveldtheorie; sterke liganden (of sterke veldliganden) en zwakke liganden (of zwakke veldliganden). Het belangrijkste verschil tussen sterke liganden en zwakke liganden is dat de splitsing van orbitalen na binding aan een sterk veldligand een groter verschil veroorzaakt tussen de orbitalen met een hoger en lager energieniveau, terwijl de splitsing van orbitalen na binding aan een zwak veldligand een lager verschil veroorzaakt tussen de hogere en lagere energieniveaus orbitalen.
Wat is de kristalveldtheorie?
Kristalenveldtheorie kan worden beschreven als een model dat is ontworpen om het breken van degeneraties (elektronenschillen van gelijke energie) van elektronenorbitalen (meestal d- of f-orbitalen) te verklaren als gevolg van het statische elektrische veld dat wordt geproduceerd door een omringende anion of anionen (of liganden). Deze theorie wordt vaak gebruikt om het gedrag van overgangsmetaalionencomplexen aan te tonen. Deze theorie kan de magnetische eigenschappen, kleuren van coördinatiecomplexen, hydratatie-enthalpieën, enz. verklaren.
Theorie:
De interactie tussen het metaalion en de liganden is het resultaat van de aantrekking tussen het metaalion met een positieve lading en de negatieve lading van de ongepaarde elektronen van het ligand. Deze theorie is voornamelijk gebaseerd op de veranderingen die optreden in vijf gedegenereerde elektronenorbitalen (een metaalatoom heeft vijf d-orbitalen). Wanneer een ligand dicht bij het metaalion komt, zijn de ongepaarde elektronen dichter bij sommige d-orbitalen dan die van andere d-orbitalen van het metaalion. Dit veroorzaakt een verlies van degeneratie. En ook stoten de elektronen in de d-orbitalen de elektronen van het ligand af (omdat beide negatief geladen zijn). Vandaar dat de d-orbitalen die zich dichter bij het ligand bevinden een hoge energie hebben dan die van andere d-orbitalen. Dit resulteert in de splitsing van d-orbitalen in d-orbitalen met hoge energie en d-orbitalen met lage energie, op basis van de energie.
Sommige factoren die deze splitsing beïnvloeden zijn; aard van het metaalion, de oxidatietoestand van metaalionen, de rangschikking van liganden rond het centrale metaalion en de aard van liganden. Na de splitsing van deze d-orbitalen op basis van energie, staat het verschil tussen de d-orbitalen met hoge en lage energie bekend als een kristalveldsplitsingsparameter (∆oct voor octaëdrische complexen).
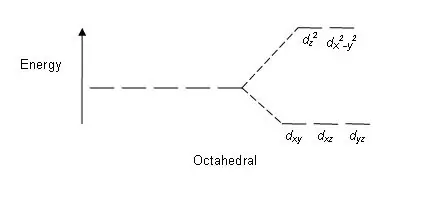
Figuur 01: Splitsingspatroon in octaëdrische complexen
Splitspatroon: aangezien er vijf d-orbitalen zijn, vindt de splitsing plaats in een verhouding van 2:3. In octaëdrische complexen bevinden twee orbitalen zich in het hoge energieniveau (gezamenlijk bekend als 'eg'), en drie orbitalen bevinden zich in het lagere energieniveau (gezamenlijk bekend als t2g). In tetraëdrische complexen gebeurt het tegenovergestelde; drie orbitalen bevinden zich in het hogere energieniveau en twee in het lagere energieniveau.
Wat is een sterke ligand?
Een sterk ligand of een sterk veldligand is een ligand dat kan resulteren in een hogere kristalveldsplitsing. Dit betekent dat de binding van een sterk veldligand een groter verschil veroorzaakt tussen de orbitalen met een hoger en lager energieniveau. Voorbeelden zijn CN- (cyanideliganden), NO2- (nitroligand) en CO (carbonyl liganden).
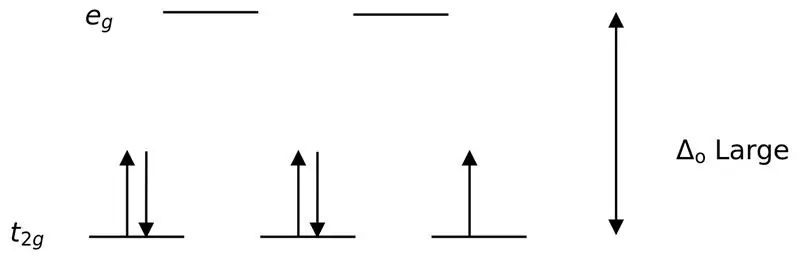
Figuur 02: Splitsen met lage spin
Bij de vorming van complexen met deze liganden worden eerst de lagere energie-orbitalen (t2g) volledig gevuld met elektronen voordat ze worden gevuld met andere orbitalen met een hoog energieniveau (bijv.). De op deze manier gevormde complexen worden "lage spin-complexen" genoemd.
Wat is een zwakke ligand?
Een zwak ligand of een zwak veldligand is een ligand dat kan resulteren in een lagere kristalveldsplitsing. Dit betekent dat de binding van een zwak veldligand een kleiner verschil veroorzaakt tussen de hogere en lagere energieniveaus orbitalen.
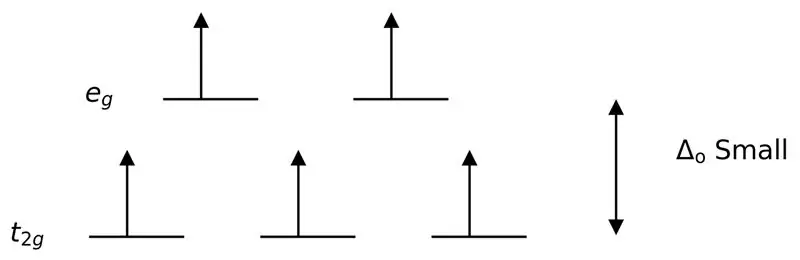
Figuur 3: Splitsen met hoge spin
In dit geval, aangezien het lage verschil tussen de twee orbitaalniveaus afstoting veroorzaakt tussen elektronen in die energieniveaus, kunnen de hogere energieorbitalen gemakkelijk worden gevuld met elektronen in vergelijking met die in lage energieorbitalen. De complexen die met deze liganden worden gevormd, worden "high spin-complexen" genoemd. Voorbeelden van zwakveldliganden zijn I- (jodideligand), Br- (bromideligand), enz.
Wat is het verschil tussen een sterke ligand en een zwakke ligand?
Sterke Ligand vs Zwakke Ligand |
|
| Een sterk ligand of een sterk veldligand is een ligand dat kan resulteren in een hogere kristalveldsplitsing. | Een zwak ligand of een zwak veldligand is een ligand dat kan resulteren in een lagere kristalveldsplitsing. |
| Theorie | |
| De splitsing na binding van een sterk veldligand veroorzaakt een groter verschil tussen de hogere en lagere energieniveaus orbitalen. | De splitsing van orbitalen na binding van een zwak veldligand veroorzaakt een kleiner verschil tussen de hogere en lagere energieniveaus orbitalen. |
| Categorie | |
| De complexen gevormd met sterke veldliganden worden "lage spin-complexen" genoemd. | De complexen gevormd met zwakke veldliganden worden "high spin-complexen" genoemd. |
Samenvatting - Sterke ligand versus zwakke ligand
Sterke liganden en zwakke liganden zijn anionen of moleculen die de d-orbitalen van een metaalion opsplitsen in twee energieniveaus. Het verschil tussen sterke liganden en zwakke liganden is dat de splitsing na binding van een sterk veldligand een groter verschil tussen de hogere en lagere energieniveau-orbitalen veroorzaakt, terwijl de splitsing van orbitalen na binding van een zwakke veldligand een kleiner verschil veroorzaakt tussen de hogere en lagere energieniveau orbitalen.






