- Auteur Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:46.
- Laatst gewijzigd 2025-06-01 07:37.
Het belangrijkste verschil tussen eerste- en tweede-ordereacties is dat de snelheid van eerste-ordereacties afhangt van de eerste macht van de reactantconcentratie in de snelheidsvergelijking, terwijl de snelheid van tweede-ordereacties afhangt van de tweede macht van de concentratie term in de tariefvergelijking.
De volgorde van een reactie is de som van de machten waartoe de reactantconcentraties worden verhoogd in de snelheidswetvergelijking. Er zijn verschillende vormen van reacties volgens deze definitie; nulde-ordereacties (deze reacties zijn niet afhankelijk van de concentratie van reactanten), eerste-ordereacties en tweede-ordereacties.
Wat zijn eerste-ordereacties?
Eerste orde reacties zijn chemische reacties waarvan de reactiesnelheid afhangt van de molaire concentratie van een van de reactanten die bij de reactie betrokken zijn. Daarom zal, volgens de bovenstaande definitie voor de volgorde van reactie, de som van de machten waartoe de reactantconcentraties worden verhoogd in de snelheidswetvergelijking altijd 1. Er kan een enkele reactant zijn die aan deze reacties deelneemt. Dan bepa alt de concentratie van die reactant de snelheid van de reactie. Maar soms zijn er meer dan één reactant die aan deze reacties deelnemen, dan bepa alt een van deze reactanten de snelheid van de reactie.
Laten we een voorbeeld bekijken om dit concept te begrijpen. In de ontledingsreactie van N2O5 vormt het NO2 en O 2 gassen als producten. Omdat het maar één reactant heeft, kunnen we de reactie en de snelheidsvergelijking als volgt schrijven.
2N2O5(g) → 4NO2(g) + O 2(g)
Rate=k[N2O5(g)]m
Hier is k de snelheidsconstante voor deze reactie en is m de volgorde van de reactie. Daarom is uit experimentele bepalingen de waarde van m 1. Dit is dus een reactie van de eerste orde.
Wat zijn tweede-ordereacties?
Tweede-ordereacties zijn chemische reacties waarvan de reactiesnelheid afhangt van de molaire concentratie van twee van de reactanten of de tweede macht van één reactant die bij de reactie betrokken was. Daarom is, volgens de bovenstaande definitie voor de volgorde van de reactie, de som van de machten waartoe de reactantconcentraties worden verhoogd in de snelheidswetvergelijking altijd 2. Als er twee reactanten zijn, zal de reactiesnelheid afhangen van de eerste macht van de concentratie van elke reactant.
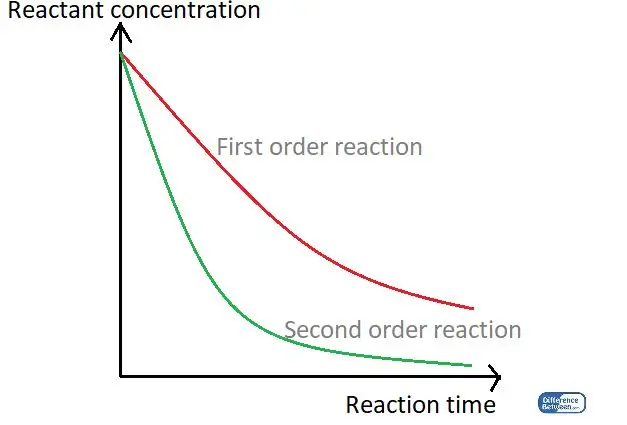
Figuur 01: Een grafiek die de twee soorten reactievolgorde vergelijkt met behulp van hun reactietijd en de reactantconcentratie.
Als we de concentratie van een reactant met 2 keer verhogen (als er twee reactanten in de snelheidsvergelijking zijn), dan neemt de reactiesnelheid toe met 4 keer. Laten we bijvoorbeeld de volgende reactie bekijken.
2A → P
Hier is A een reactant en P is het product. Als dit een reactie van de tweede orde is, is de snelheidsvergelijking voor deze reactie als volgt.
Tarief=k[A]2
Maar voor een reactie met twee verschillende reactanten, zoals:
A + B → P
Rate=k[A]1[B]1
Wat is het verschil tussen reacties van de eerste en tweede orde?
Eerste orde reacties zijn chemische reacties waarvan de reactiesnelheid afhangt van de molaire concentratie van een van de reactanten die bij de reactie betrokken zijn. Daarom, als we de concentratie van reactant met 2 keer verhogen, neemt de reactiesnelheid met 2 keer toe. Tweede orde reacties zijn chemische reacties waarvan de reactiesnelheid afhangt van de molaire concentratie van twee van de reactanten of de tweede macht van één reactant die bij de reactie betrokken is. Dus als we de concentratie van reactant met 2 keer verhogen, neemt de reactiesnelheid met 4 keer toe. De onderstaande infographic geeft het verschil weer tussen eerste- en tweede-ordereacties in tabelvorm.

Samenvatting - Eerste versus tweede orde reacties
Er zijn drie hoofdtypen reacties volgens de volgorde van de reactie; nulde orde, eerste orde en tweede orde reacties. Het belangrijkste verschil tussen eerste- en tweede-ordereacties is dat de snelheid van een eerste-ordereactie afhangt van de eerste macht van de reactantconcentratie in de snelheidsvergelijking, terwijl de snelheid van een tweede-ordereactie afhangt van de tweede macht van de concentratieterm in de tarief vergelijking.






