- Auteur Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:46.
- Laatst gewijzigd 2025-06-01 07:37.
Het belangrijkste verschil tussen stikstofmonoxide en distikstofpentoxide is dat stikstofmonoxide een kleurloos gas is, terwijl distikstofpentoxide een witte vaste stof is.
Stikstofmonoxide en distikstofpentoxide zijn chemische verbindingen die stikstof en zuurstof bevatten. Dit zijn stikstofoxiden. Ze hebben echter verschillende chemische en fysische eigenschappen.
Wat is stikstofmonoxide?
Stikstofmonoxide is een anorganische verbinding met de chemische formule NO. We noemen het stikstofmonoxide omdat het een stikstofoxide is. Het is eigenlijk een vrije radicaal omdat het een ongepaard elektron heeft. Bovendien is het een heteronucleair diatomisch molecuul.
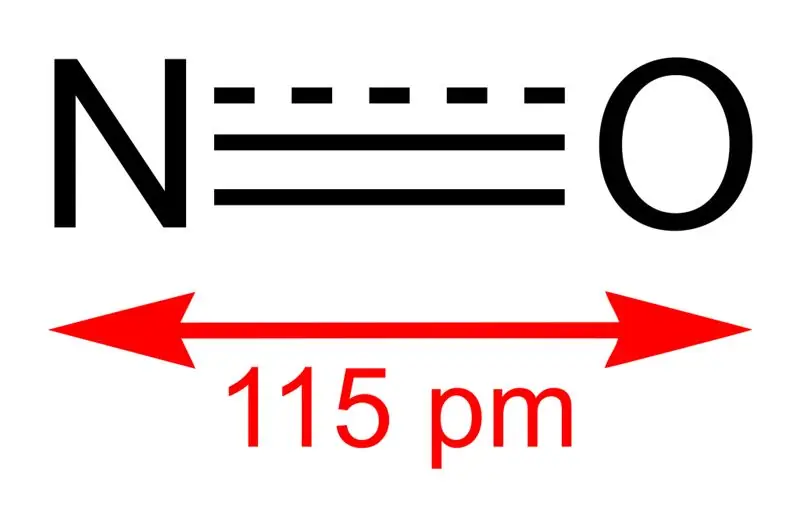
Figuur 01: Structuur van stikstofmonoxide en de bindingslengte tussen N en O
De molaire massa van deze verbinding is 30 g/mol. Het komt voor als een kleurloos gas. Bovendien is het smeltpunt -164 ° C, terwijl het kookpunt -152 ° C is, wat zeer kleine waarden zijn in vergelijking met die van andere stikstofoxiden. Deze vrije radicaal kunnen we produceren via oxidatie van ammoniak bij 850 °C in aanwezigheid van een platinakatalysator. Op laboratoriumschaal kunnen we het echter bereiden door verdund salpeterzuur met koper te reduceren.
Wat is distikstofpentoxide?
Distikstofpentoxide is een anorganische verbinding met de chemische formule N2O5 We noemen het stikstofpentoxide. Het is een binair stikstofoxide. Bovendien is het onstabiel en kan het werken als een gevaarlijk oxidatiemiddel. De molaire massa van de verbinding is 108,01 g/mol. Het komt voor als een vaste witte kleur.
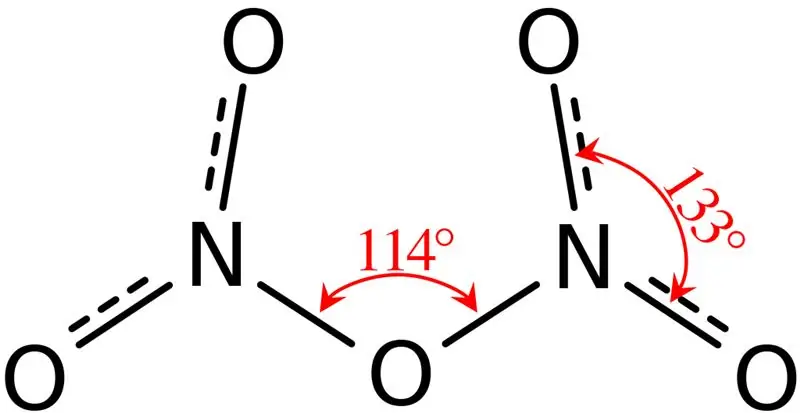
Figuur 02: Structuur van distikstofpentoxide
Bovendien is het smeltpunt van deze verbinding 41 °C en bij 47 °C ondergaat deze verbinding sublimatie. Deze verbinding reageert met water en geeft salpeterzuur. Bovendien is de moleculaire vorm van het distikstofpentoxidemolecuul vlak. We kunnen deze verbinding produceren door salpeterzuur te dehydrateren met fosforpentoxide.
Wat is het verschil tussen stikstofmonoxide en distikstofpentoxide?
Stikstofmonoxide is een anorganische verbinding met de chemische formule NO, terwijl distikstofpentoxide een anorganische verbinding is met de chemische formule N2O5 Het belangrijkste verschil tussen stikstofmonoxide en distikstofpentoxide is dat stikstofmonoxide een kleurloos gas is, terwijl distikstofpentoxide een witte vaste stof is. Bovendien kunnen we stikstofmonoxide produceren via oxidatie van ammoniak bij 850 °C in aanwezigheid van een platinakatalysator. De productie van distikstofpentoxide vindt echter plaats via dehydratering van salpeterzuur met fosforpentoxide. Bij het beschouwen van de moleculaire vorm is stikstofmonoxide lineair, terwijl distikstofpentoxide vlak is.
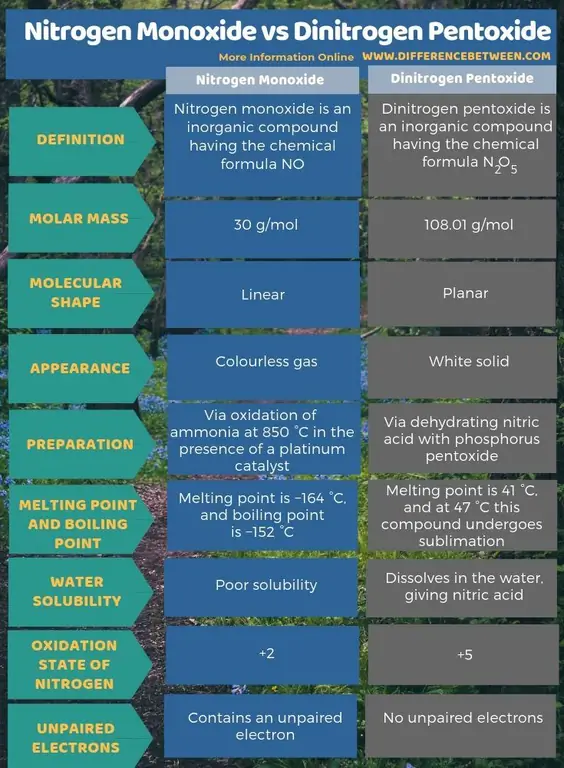
Samenvatting - Stikstofmonoxide versus distikstofpentoxide
Stikstofmonoxide is een anorganische verbinding met de chemische formule NO, terwijl distikstofpentoxide een anorganische verbinding is met de chemische formule N2O5 Het belangrijkste verschil tussen stikstofmonoxide en distikstofpentoxide is dat stikstofmonoxide een kleurloos gas is, terwijl distikstofpentoxide een witte vaste stof is.






