- Auteur Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:46.
- Laatst gewijzigd 2025-06-01 07:37.
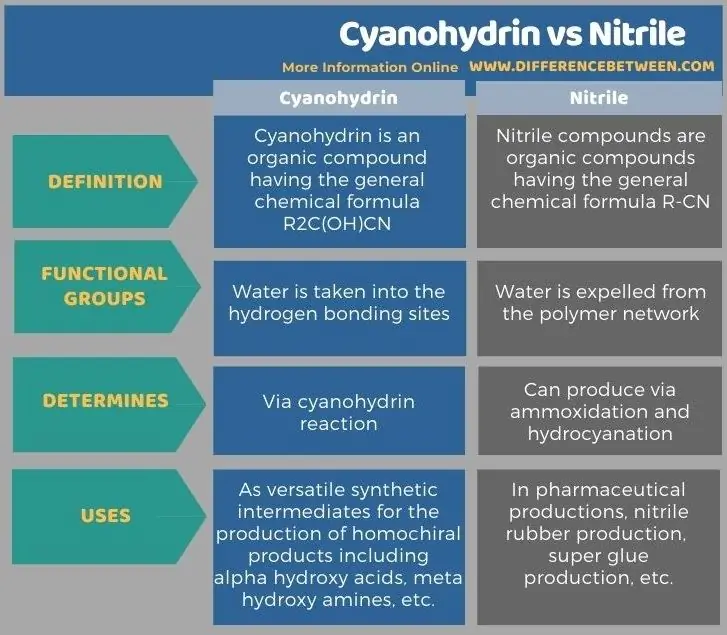
Het belangrijkste verschil tussen cyaanhydrine en nitril is dat cyaanhydrineverbindingen een cyaangroep en een hydroxygroep bevatten, terwijl nitrilverbindingen alleen cyaangroepen bevatten.
Zowel cyaanhydrine als nitrilverbindingen bevatten cyanogroepen (functionele groep -CN). Deze verbindingen hebben deze functionele groepen bevestigd aan een alkyl- of arylgroep; dus kunnen we ze categoriseren als organische verbindingen.
Wat is cyanohydrine?
Cyaanhydrine is een organische verbinding met de algemene chemische formule R2C(OH)CN. Deze verbindingen hebben twee functionele groepen per molecuul: cyanogroep en hydroxygroep. Deze twee functionele groepen zitten vast aan hetzelfde koolstofatoom. Dit koolstofatoom is verder gehecht aan een alkyl- of een arylgroep, of er kunnen beide soorten R-groepen zijn.
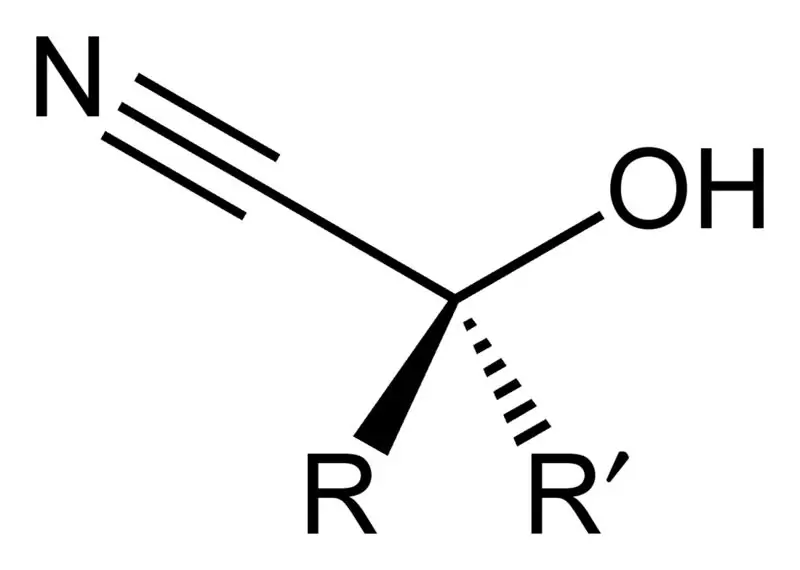
Industrieel zijn cyanohydrineverbindingen belangrijk als voorlopers voor de productie van carbonzuren en ook voor sommige aminozuren. Deze cyaanhydrineverbindingen ontstaan uit een cyaanhydrinereactie waarbij een keton of een aldehyde wordt behandeld met waterstofcyanide (HCN) in aanwezigheid van natriumcyanide in een overmatige hoeveelheid als katalysator. Tijdens deze productiereactie fungeert de cyanogroep (CN-) van waterstofcyanide als de nucleofiel, die de elektrofiele carbonylkoolstof in het keton of aldehyde aanv alt. Deze reactie wordt gevolgd door protonering door HCN, wat leidt tot de regeneratie van cyanide-anion. We kunnen echter ook cyanohydrines bereiden door sulfiet te verdringen door cyanidezouten.
De meest voorkomende en belangrijkste cyanohydrineverbinding is acetoncyaanhydrine. Het is het cyaanhydrine van aceton dat wordt gevormd als tussenproduct bij de industriële productie van methylmethacrylaat. Deze stof bestaat als vloeistof en kan dienen als bron van HCN.
Wat is nitril?
Nitrilverbindingen zijn organische verbindingen met de algemene chemische formule R-CN. Dat betekent dat deze verbindingen een cyaangroep hebben. Daarom wordt de term cyano- gewoonlijk door elkaar gebruikt met de term nitril in industriële toepassingen. Er zijn veel belangrijke toepassingen van nitrilverbindingen, waaronder de vorming van methylcyanoacrylaat, bij de productie van superlijm, nitrilrubber, nitrilbevattende polymeren die nuttig zijn bij de productie van medische handschoenen, enz. Er zijn ook veel toepassingen van nitrilrubber; vooral als auto- en andere afdichtingen vanwege de weerstand tegen brandstof en olie. Belangrijker is dat anorganische verbindingen die de cyaangroep bevatten geen nitrilverbindingen worden genoemd; ze worden in plaats daarvan cyaniden genoemd.

Als we kijken naar de structuur, zijn nitrillen lineaire moleculen. Deze moleculen weerspiegelen de sp-hybridisatie van het koolstofatoom met de drievoudige binding met het stikstofatoom. Nitrilverbindingen zijn polair en hebben een dipoolmoment. Nitrilverbindingen komen voor als vloeistoffen met hoge relatieve permittiviteiten.
We kunnen nitrilverbindingen industrieel produceren via ammoxidatie en hydrocyanering. Beide routes zijn duurzaam (groen) en hebben een minimale uitstoot van gevaarlijke stoffen.
Wat is het verschil tussen cyanohydrine en nitril?
Cyaanhydrine en nitrilverbindingen zijn organische verbindingen die de cyaanfunctionele groep bevatten. Het belangrijkste verschil tussen cyaanhydrine en nitril is dat cyaanhydrineverbindingen een cyaangroep en een hydroxygroep bevatten, terwijl nitrilverbindingen alleen cyaangroepen bevatten. Bovendien wordt cyaanhydrine geproduceerd via een cyaanhydrinereactie, terwijl nitril kan worden geproduceerd via ammoxidatie en hydrocyanering.
Hieronder worden in infographics meer verschillen weergegeven tussen cyanohydrine en nitril.
Samenvatting - Cyaanhydrine versus nitril
Cyaanhydrine en nitrilverbindingen zijn organische verbindingen die de cyaanfunctionele groep bevatten. Het belangrijkste verschil tussen cyaanhydrine en nitril is dat cyaanhydrineverbindingen een cyaangroep en een hydroxygroep bevatten, terwijl nitrilverbindingen alleen cyaangroepen bevatten.






